Le sérum physiologique est une solution très utilisée pour le nettoyage des yeux des bébés par exemple. Cette solution contient de l’eau et du Chlorure de Sodium NaCl à 0,9 %. Ce qui signifie que 100g de sérum physiologique contiennent 0,9g de Chlorure de sodium.
Nous allons vérifier si le sérum physiologique que l’on a dans la pharmacie du laboratoire de chimie, est conforme à l’étiquette.
Pour cela on propose de réaliser un dosage conductimétrique par étalonnage.
1 : préparation de la gamme étalon :
On prépare des solutions dans des fioles de 50mL à partir d’une solution mère de chlorure de sodium à 1,0.10-2 mol.L-1
|
Solution diluée
|
S1
|
S2
|
S3
|
S4
|
S5
|
|
C (mmol.L-1)
|
1
|
3
|
5
|
7
|
9
|
|
Vs.phy (mL)
|
|
|
|
|
|
|
Veau (mL)
|
|
|
|
|
|
2 : préparation de la solution de sérum physiologique :
Le sérum physiologique à 0.9% (soit 9g.L-1) est également diluée 20 fois. Réaliser la dilution après validation du protocole par l’enseignant.
3 : réalisation des mesures de conductivité

L a conductivité σ dépend de la nature des ions Xi en solution, de la concentration des ions [Xi] (en mol.m-3 ) et de la température Ɵ.
La loi de Kohlrausch indique que la conductivité σ se calcule par la relation :
σ=Σλi[Xi]
où λ= conductivité molaire des ions en solution (S.m².mol-1)
λH30+= 35.10-3 ; λHO-=19,9.10-3 ; λNa+= 5,01.10-3 ; λCl-=7,63.10-3
Exprimer la loi de Kohlrausch applicable au sérum physiologique :
A l’aide du conductimètre, relever les valeurs de δ (µS.cm-1) pour chacune des solutions, puis pour le sérum physiologique dilué :
|
Solution n°
|
0
|
1
|
2
|
3
|
4
|
5
|
s.phy
|
|
C (mmol.L-1)
|
0
|
1
|
3
|
5
|
7
|
9
|
|
|
δ (µS.cm-1)
|
|
|
|
|
|
|
|
4 : réalisation de la courbe d’étalonnage
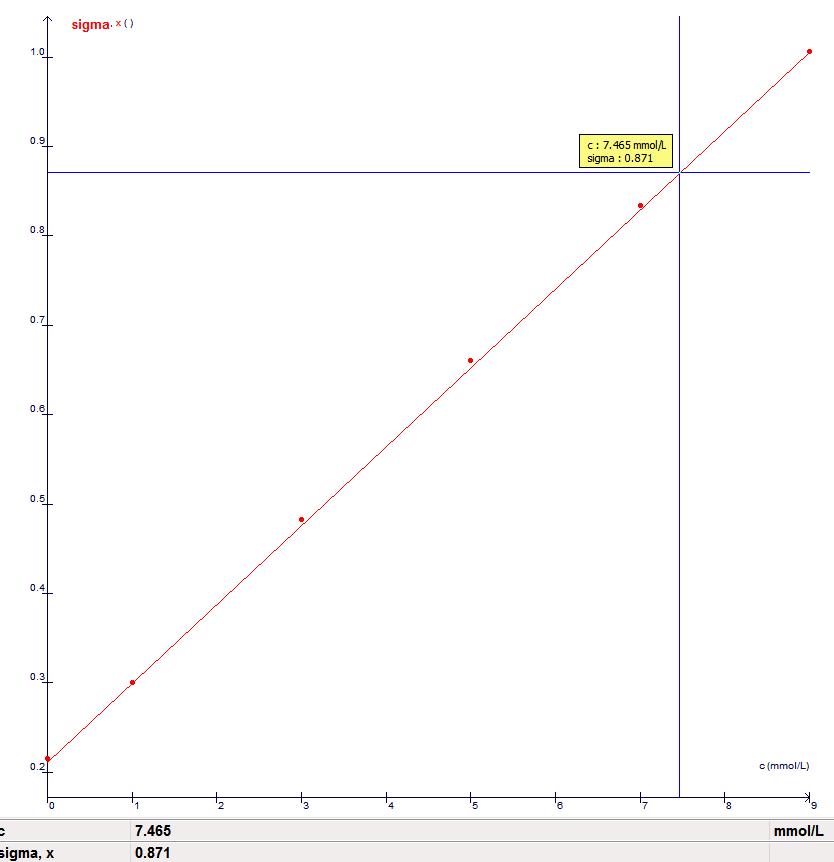
Avec le logiciel Atelier Scientifique, on trace la droite A=f(C) puis avec le pointeur on se place sur la droite à A=
Relever la valeur de C correspondante
Retrouver, par le calcul, la teneur en Chlorure de Sodium du sérum physiologique.
Ce résultat est-il conforme à l’étiquette ? Calculer l’écart relatif=|Cth-Cexp/Cth| si <5 % produit conforme.

5 : Correction et Calculs :
|
Solution diluée
|
S1
|
S2
|
S3
|
S4
|
S5
|
|
C (mmol.L-1)
|
1
|
3
|
5
|
7
|
9
|
|
Vs.phy (mL)
|
5
|
15
|
25
|
35
|
45
|
|
Veau (mL)
|
45
|
35
|
25
|
15
|
5
|
|
Solution n°
|
0
|
1
|
2
|
3
|
4
|
5
|
s.phy
|
|
C (mmol.L-1)
|
0
|
1
|
3
|
5
|
7
|
9
|
A det
|
|
δ (µS.cm-1)
|
0.2154
|
0.3007
|
0.483
|
0.661
|
0.834
|
1.006
|
0.871
|
A= 0.871 et on relève la concentration de 7.465 mmol.L-1
CSphy dilué=7.465 mmol.L-1
CSphy= 20 x CSphy dilué=20 x 7.465 mmol.L-1 =149.3=0.1493mol.L-1
Cm=C x M=0.1493 x 58.44=8.72 g.L-1 Er=|9-8,72/9|x100=3,1 %<5 % donc conforme




