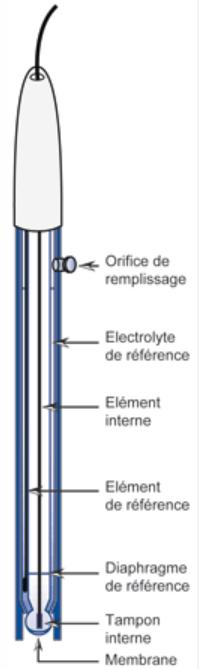
La verrerie : prélèvement de volumes
On peut se demander qu’elle est la verrerie la plus adaptée au prélèvement que l’on doit effectuer.
Il est donc important de regarder la forme du volume à prélever que l’on vous demande.
En suivant ce lien ⇒ Vous trouverez un TP réalisé pour les classes de 2nde et 1ère
Par exemple, si on vous demande de prélever 5,0 mL, il va être judicieux de prélever avec une pipette jaugée plutôt qu’avec une éprouvette graduée.
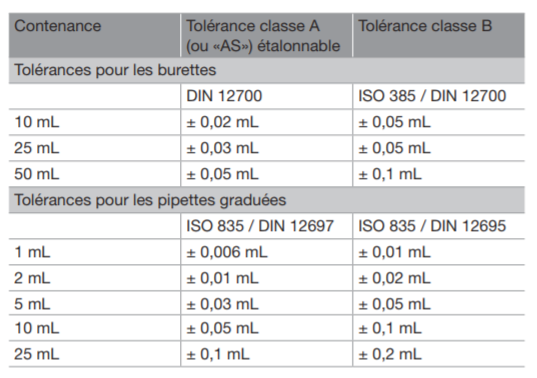
En effet sur la verrerie vous avez des classes indiquées ce qui induit la hauteur de la précision.
Mais celle-ci varie en fonction de la verrerie.
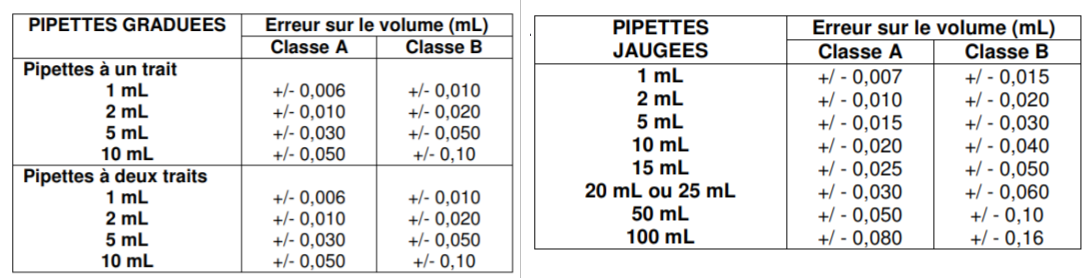
Dans tous les cas il faut regarder sur votre verrerie.

Il existe la verrerie classe A ou AS ( avec un débit de sortie plus rapide) et classe B ( moins précise que la classe A). De même les pipettes jaugées 2 traits sont plus précises que les pipettes jaugées 1 trait. Donc en concours si vous avez le choix de la verrerie pour prélever de petits volumes comme 5,0 ou 10,0mL prenez plutôt une pipette jaugée 2 traits.
Attention : on utilise toujours une propipette (poire ou seringue) pour prélever un volume avec une pipette !
On se place bien en face du trait de jauge de la pipette. Le bas du ménisque du volume prélevé doit coïncider avec le trait de jauge de la pipette. Attention, si on utilise une pipette jaugée 2 traits, il faudra bien regarder le trait de jauge du bas en versant le volume prélevé.
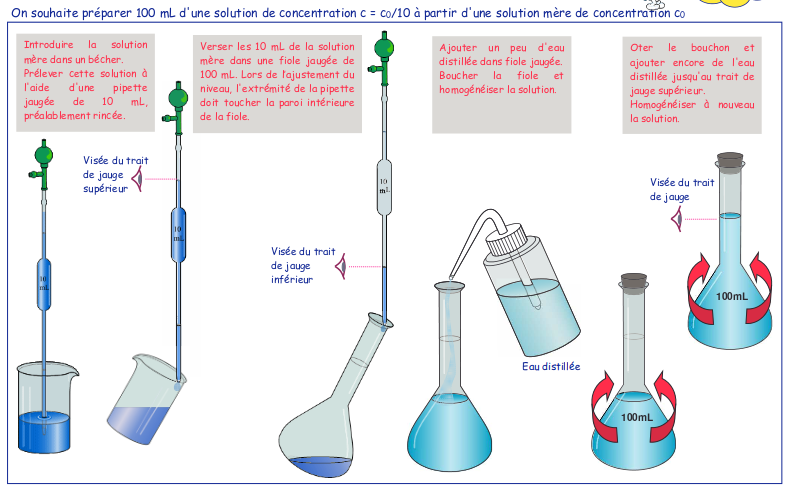
Par contre, il est bon de savoir qu’une fiole jaugée ne sert pas à prélever un volume précis d’une solution. Elle est utilisée pour préparer des volumes précis de solutions. Mais j’en convient, il nous arrive dans les laboratoires, si on doit prélever un volume de 100,0mL, plutôt que d’utiliser une pipette jaugée de 100,0mL qui va être assez long à prélever, il arrive que l’on utilise une fiole jaugée de 100mL propre et sèche et qu’on la rince après, mais cela est possible si après, la solution que vous avez préparé, est dosée précisément.
La burette peut être utilisée comme verrerie de prélèvement, son avantage : quand on a des prélèvements successifs d’une même solution à réaliser elle est utile et plus précise qu’une pipette graduée.
Si on vous demande rajouter environ 100mL d’eau distillée ( comme pour les dosages pH-métrique par exemple) une éprouvette graduée de 100mL est suffisante ( d’autant plus que la quantité d’eau que l’on rajoute n’influe pas sur le résultat du dosage).
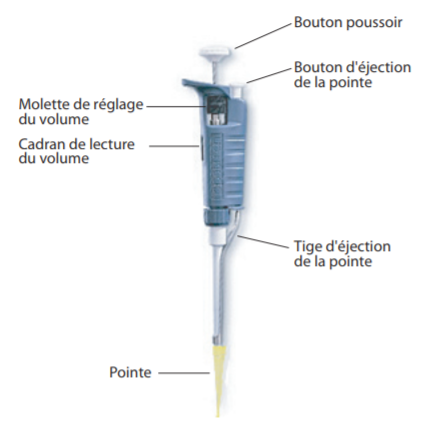
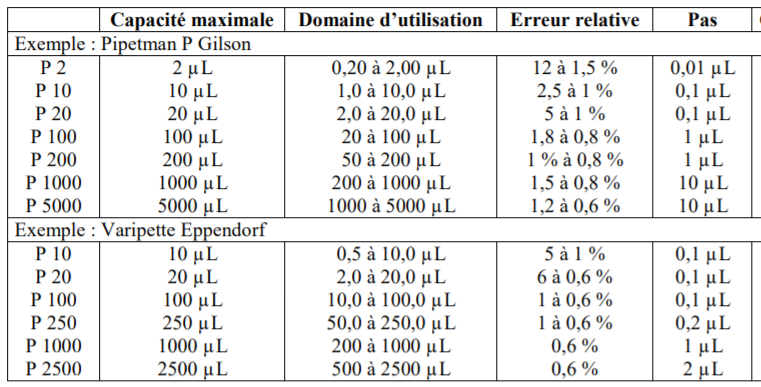
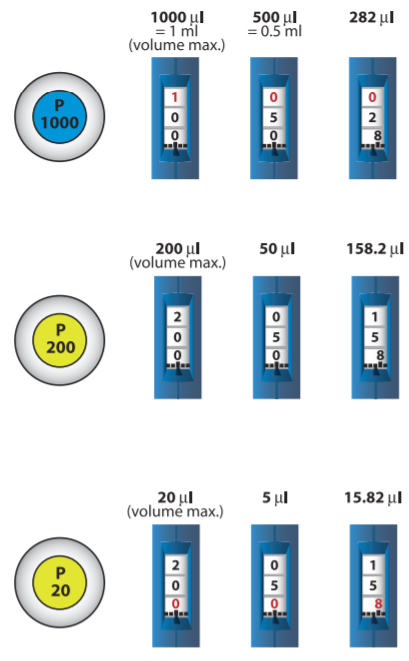
Pour de très petits volumes, il convient d’utiliser des micropipettes P200 ( pour prélever de 20 à 200µL par exemple) , P100, P50…
Elles ont un volume de solutions très précis à prélever, souvent utilisées en microbiologie.
Pour mettre en place la pointe, on n’utilise pas les mains, mais on les prend dans la boite, en ayant pris soin d’installer un « coton de sécurité »
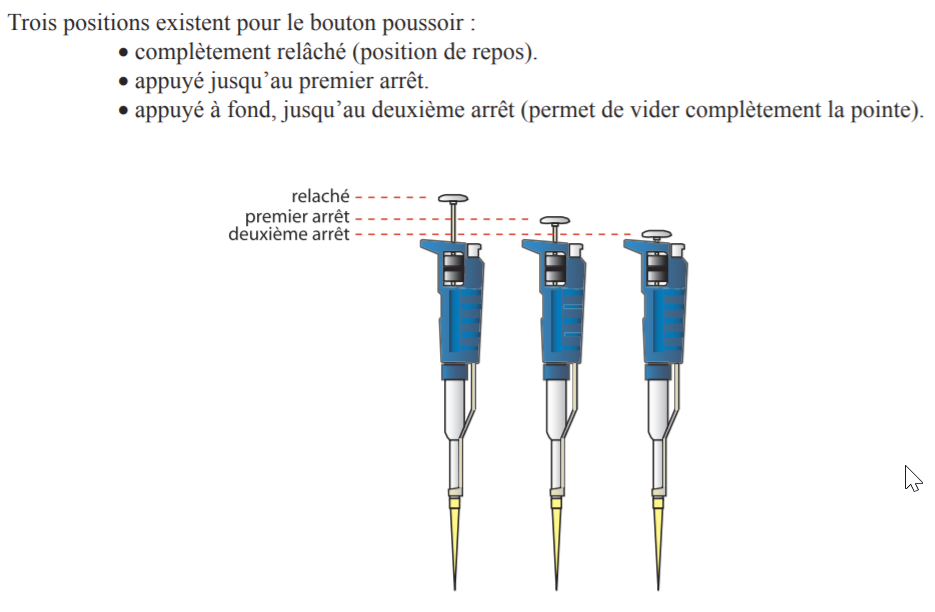
Leur protocole d’utilisation nécessite quand même un petit coup de main :
– Régler le volume à prélever et placer l’embout approprié.Le volume prélevé par la pipette est indiqué dans le cadran de lecture. Pour changer le volume tourner la molette de réglage jusqu’à la quantité indiquée. Attention : Ne jamais tourner la molette au delà de la quantité maximale supportée par la pipette : Ne pas dépasser 1000 µl avec la P1000 Ne pas dépasser 200 µl avec la P200
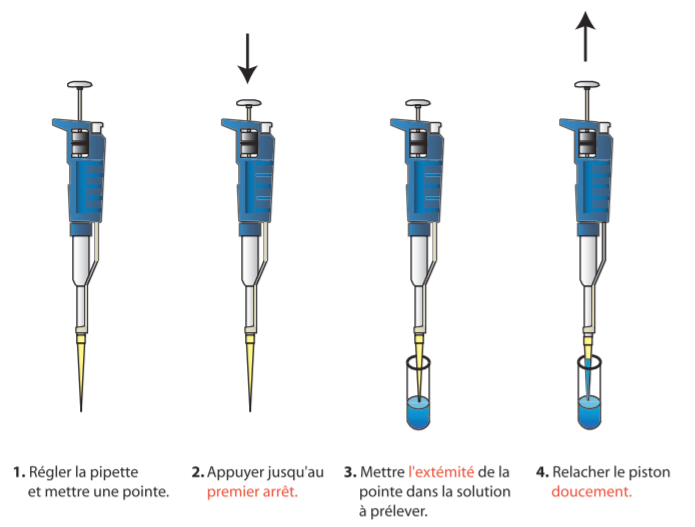
– Rincer l’embout ou cône : – cône en dehors de la solution, appuyer sur le bouton poussoir de la pipette jusqu’à la première butée, – introduire 2 à 5 mm de l’extrémité du cône dans la solution à prélever et relâcher lentement le bouton poussoir pour aspirer la solution sans faire de turbulences, – rejeter le liquide aspiré dans la solution ou dans une poubelle en appuyant à fond sur le bouton poussoir. Lors de ce rinçage, bien vérifier l’étanchéité entre le cône et la pipette ainsi que le bon état du de l’embout.
– Prélever la solution : – cône en dehors de la solution, appuyer sur le bouton poussoir jusqu’à la première butée, – pipette tenue verticalement, introduire l’extrémité du cône dans la solution et relâcher lentement le bouton poussoir pour aspirer la solution, – vérifier l’absence de bulles d’air et essuyer avec du papier filtre les éventuelles gouttelettes de liquide sur la paroi extérieure du cône sans toucher l’orifice.
– délivrer lentement la solution en pressant complètement sur le bouton poussoir.
La pipette est maintenue verticalement, l’extrémité du cône s’appuie contre la paroi du récipient tenu en main selon un angle de 10° à 40°. L’écoulement de la solution se fait contre la paroi du récipient, sans toucher le liquide déjà présent.
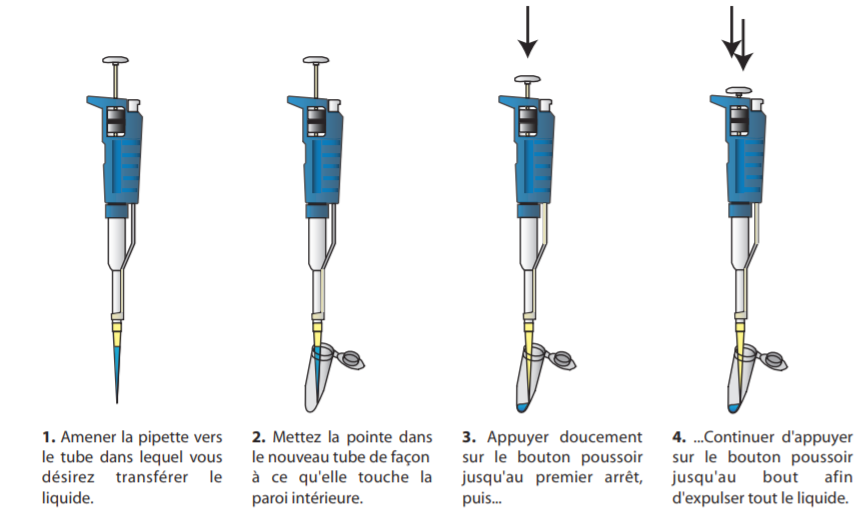
– Remise en place : relâcher le bouton poussoir, jeter le cône souillé dans une poubelle et poser la pipette sur son support.
source pour la micropipette: https://www.bioutils.ch/informations-pratiques/utilisation-des-micropipettes