non non, rien de grave… 😉
Juste quelques infos sur la gravitation et le Poids…
Bonne lecture
gravit
Aujourd’hui je vous propose un sujet de TP pour réaliser un dosage conductimétrique.
En deuxième page du pdf, je vous ai mis la correction et les résultats que j’ai obtenu…
Bon TP à tous.
tp agneau
Si vous utilisez notre document, n’oubliez pas de nous citer!
Cours : L’oxydoréduction
1 : Définitions
Toute réaction chimique mettant en jeu un transfert d’électrons (noté e–) est appelé réaction d’oxydoréduction.
Un oxydant est un espèce chimique susceptible de capter au moins un électron. On dit qu’il est réduit.
Un réducteur est une espèce chimique susceptible de céder au moins un électron. On dit qu’il s’oxyde.
2 : Couple oxydant/réducteur
Deux entités chimiques qui ne diffèrent que par leur nombre d’électrons, constituent un couple oxydant/réducteur simple. Ainsi 2 espèces chimiques sont dites conjuguées et forme un couple oxydant/réducteur, noté Ox/Red, si elles peuvent être reliées par la demi-équation d’oxydoréduction :
Ox + ne– = Red
Une oxydation correspond à une perte d’électrons, alors qu’une réduction correspond à un gain d’électrons.
Les demi-équations respectent les mêmes règles d’ajustement de stœchiométrie que les équations chimiques.
Ex : pour le couple I2/I– la demi-équation est I2 + 2e– = 2I–
pour le couple Fe3+/Fe2+ la demi-équation est Fe3+ + 1e– = Fe2+
3 : Réaction d’oxydoréduction
Elle est le siège d’un échange d’électrons entre le réducteur d’un couple qui cède les électrons et l’oxydant d’un autre couple qui les accepte. Cela doit ressortir avec les coefficients stœchiométriques. En effet, après avoir écrit les demi-équations des 2 couples mis en jeu dans une réaction chimique, on obtient l’équation de la réaction en combinant les égalités.
Ox1/Red1 avec Ox1 + ne– = Red1 et Ox2/Red2 avec Ox2 + ne– = Red2
ce qui donne la réaction aRed1 + bOx2 → cOx1 + dRed2 avec a,b,c,d les coefficients stœchiométriques.
Ex : Fe3+/Fe2+ la demi-équation est Fe3+ + 1e– = Fe2+
Cu2+/Cu la demi-équation est Cu2+ + 2e– = Cu
d’où, une fois le nombre d’électrons équilibré, donne l’équation d ela réaction : 2x(Fe3+ + 1e– = Fe2+)
Cu2+ + 2e– = Cu
2Fe3+ + Cu = 2Fe2+ + Cu2+
4 : Équilibrer une demi-équation d’oxydoréduction
Pour certains couples Ox/Red, l’ajustement des coefficients stœchiométriques est plus compliqué. C’est pourquoi il existe une méthode qui fonctionne à tous les coups, si on la suit étape par étape. Pour cela, nous prendrons l’exemple du couple MnO4–/ Mn2+.
Étape 1 : écrire la demi-équation sous la forme classique :
MnO4– + ne– = Mn2+
Étape 2 : assurer la conservation de l’élément principal (ici le manganèse)
Étape 3 : Assurer la conservation de l’oxygène en ajustant avec l’eau H2O
MnO4– + ne– = Mn2+ +4H2O
Étape 4 : Assurer la conservation de l’hydrogène en ajustant avec l’ion H+
MnO4– + ne– + 8H+ = Mn2+ +4H2O
Étape 5 : assurer la conservation des électrons
MnO4– + 5e– + 8H+ = Mn2+ +4H2O
Voici un petit tableau récapitulatif des dosages couramment utilisés au labo avec les produits à doser, l’indicateur coloré et la formule de calcul de concentration du dosage…
| produit | réactif | indicateur coloré | calcul | exemple de concentrations |
| acide éthanoïque | NaOH | phénolphtaléine | CaVa=CbVb | |
| ammoniaque | HCl | rouge d eméthyl | CaVa=CbVb | |
| I2 | thiosulfate de sodium | thiodène | 2CIVI=CthioVthio | CI=4.10-2 mol/L
VI=10mL Cthio=0,1 mol/L Veq≈7,8mL |
| HCl | NaOH | BBT | CaVa=CbVb | |
| KMnO4 | sel de Mohr acidifié | 5CKMnO4VKMnO4=CFeVFe | CKMnO4=1.10-2mol.L
VKMnO4=12mL CFe=3.10-2mol/L VFe=20mL |
|
| KMnO4 | H2O2 | 5CKMnO4VKMnO4=2CH2O2VH2O2 | CKMnO4=2.10-2mol/L
VKMnO4=17,6mL CH2O2=8,8.10-2mol/L VH2O2=10mL |
|
| AgNO3 | NaCl | conductimétrique
ou dichromate de potassium |
CAgVAg=CCl-VCl- | |
| H2SO4 | NaOH | BBT | 2CaVa=CbVb | Ca=0,05 mol/L
Va=10mL Cb=0,1mol/L Vb=10mL |
Je vous propose quelques rappels sur les atomes, la composition, le classement…
Très utile en 2nde par exemple…
Voici un petit document “exercice” à faire remplir aux élèves
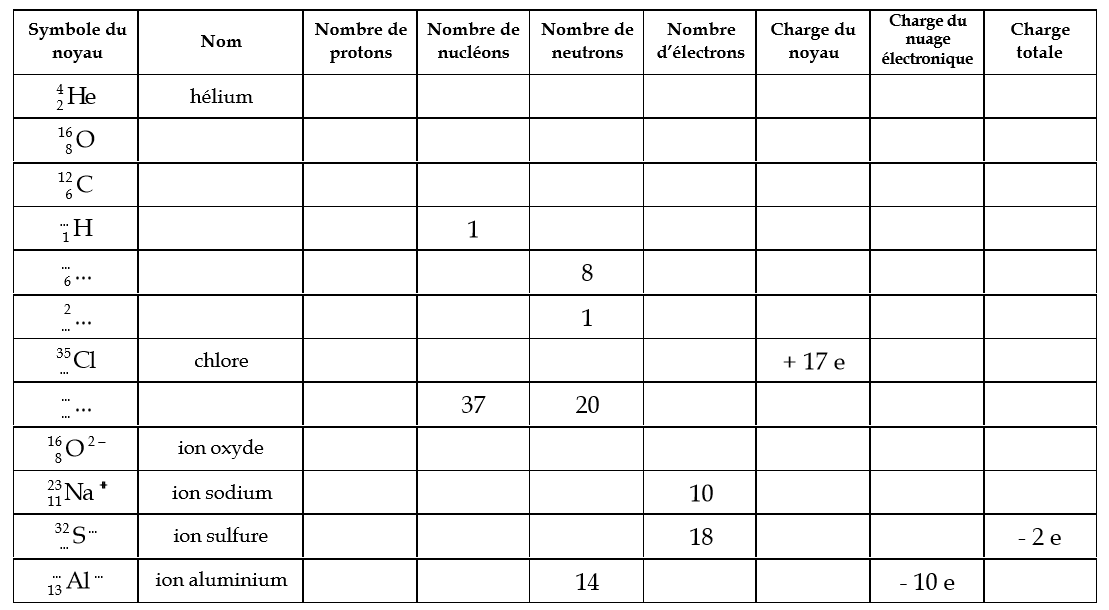
Vous pouvez en profiter pour faire un escape game que j’ai réalisé pour faire travailler les élèves sur la classification périodique. cf le lien suivant ⇒
Bonne lecture à tous
cours atome
Je vous propose un petit rappel de cours sur les notions de fréquence, période… Très utile en 2nde.
Avec un petit exemple applicable en TP sur la fréquence cardiaque…
Bonne lecture!
cours freq
un petit document avec des rappels et des exemples sur les forces et le principe d’inertie…
Bonne lecture
cours force inertie
Aujourd’hui je vous propose un TP, réalisable à plusieurs niveaux, sur la synthèse de l’arôme de banane.

Bon TP à tous
TP arome banane
Si vous utilisez notre document, n’oubliez pas de nous citer!
Retrouvez une autre version de ce TP dans le lien suivant ⇒
Si vous n’avez pas tous les produits pour l’identification, vous pouvez utiliser:
– avec le système réflexion réfraction, sachant que l’indice de réfraction de l’arôme de banane est de 1,3981
– avec la détermination de la masse volumique, en théorie la masse volumique de l’arôme de banane est de 0,87g/mL
Aujourd’hui je vous propose un TP, un ancien TP car on ne le réalise plus, mais avec le nouveau programme en TS il va peut-être revenir, qui sait 😉
Le TP sur la métallurgie du Zinc, avec une première partie réalisée en amont du TP.
La partie expérimentale est une électrolyse avec un calcul de rendement.
Bon TP à tous
TP metallurgie zinc
Si vous utilisez notre document, n’oubliez pas de nous citer!
Je vous propose un TP réalise en 2nde sur les effets thermiques de la dissolution.
Les élèves ont une recherche de protocole simple à réaliser.
Le contexte du TP fait qu’ils devront aider une infirmière à soigner un élève blesser en sport.
Je vous ai mis en 2ème page du TP, les résultats que j’ai obtenu dans mon labo lors de mes essais.
Vous pouvez également travailler avec du Chlorure d’ammonium et du thiosulfate de sodium anhydre
Bon TP à tous
tp effet thermiq
Si vous utilisez notre document, n’oubliez pas de nous citer!